En esta página se desarrollan, desde un punto de vista conceptual, las similitudes y diferencias entre los diferentes estados de la materia. También se introduce el concepto de Equilibrios de Fases y su importancia en la caracterización de reservorios.
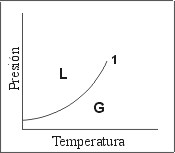
En la Fig. 1 se muestra un diagrama de fases típico para equilibrios Líquido-Vapor. En base a las variables representadas en ambos ejes de coordenadas, este diagrama suele designarse como diagrama P-T (Presión-Temperatura). El caso graficado representa la situación habitual para el equilibrio de fases de un componente puro (Sistema de un solo componente). Por lo tanto las conclusiones alcanzadas son aplicables al metano puro, al agua pura, al benceno puro o a cualquier otro compuesto individual.
|
|
|
Fig. 1: Diagrama P-T, para un sólo componente |
En este diagrama se suelen marcar algunas zonas y puntos característicos:
-
La curva que termina en el punto "1" une los puntos de presión y temperatura en los que pueden coexistir la fase líquida y la fase gaseosa.
-
El punto identificado como "1" hace referencia a lo que se conoce como punto crítico del sistema. Representa la máxima temperatura y la máxima presión a la que pueden coexistir Gas y Líquido.
-
Las "zonas" identificadas con las letras "L" y "G" representan las áreas de este diagrama en que el sistema se encuentra como Gas o cómo Líquido.
Algunas conclusiones simples derivadas de este diagrama son las siguientes.
-
Se observa que una vez fijada la temperatura, existe una sola presión de coexistencia entre las dos fases. A presiones mayores a ésta, todo el sistema se encuentra en fase líquida. Y a presiones menores todo el sistema se encuentra en fase gaseosa. Algunos autores prefieren llamar Vapor a la fase gaseosa cuando se encuentra a temperaturas inferiores a la temperatura crítica (donde se puede generar líquido mediante una compresión isotérmica). Por razones que se explicitarán en los próximos párrafos, este tipo de denominaciones tiende a oscurecer detalles mucho más significativos.
-
Cuando se varía isotérmicamente la presión de un fluido que se encuentra a temperaturas superiores a la temperatura crítica, no se observan cambios de fase en el sistema, por mucho que se aumente o disminuya la presión. Los gases permanentes (Nitrógeno, oxígeno, helio, etc) son un ejemplo de este comportamiento a temperatura ambiente: No es posible formar líquido mediante la compresión de estos gases a temperatura ambiente.
-
Tampoco es posible separar una fase líquida por enfriamiento de un fluido a presiones por encima de la presión crítica.
Sin embargo mediante un análisis más detallado de este diagrama pueden obtenerse algunos resultados aparentemente sorprendentes.
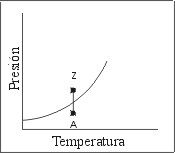
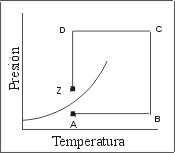
Las Fig. 2 y 3 muestran dos caminos termodinámicos alternativos para llevar un mismo sistema desde las condiciones correspondientes al punto "A" hasta las condiciones del punto "Z".
-
En el camino esquematizado en la Fig. 2 se realiza una compresión isotérmica, de modo que al cortar la curva de equilibrio Líquido-Vapor se observa el cambio de fase en el sistema. De este modo parece natural afirmar que, durante la compresión isotérmica, partiendo del gas "A" se obtuvo el líquido "Z".
-
En el camino elegido en la Fig. 3 también se parte del punto "A" y se llega al punto "Z", pero se recorre un camino que implica un calentamiento isobárico (A-B), una compresión isotérmica (B-C), un calentamiento isobárico (C-D) y una expansión isotérmica (D-Z). Sin embargo, pese a que se alcanza el mismo estado final, en ningún momento se produce un cambio de fase.
|
|
|
| Fig. 2: Camino Termodinámico Isotérmico | Fig. 3: Camino Termodinámico Alternativo |
Basados en la conclusión preliminar aportada por la Fig. 2, podríamos decir que mediante el recorrido termodinámico de la Fig. 3 hemos transformado un gas en líquido sin producir un cambio de fases.
Cabe aclarar que los equilibrios termodinámicos no registran la historia previa del sistema. Una vez alcanzado el punto "Z" no hay manera de determinar si se alcanzó a través del camino de la Fig. 2, el de la Fig. 3 o cualquier otro camino posible. Si afirmamos que el punto "Z" corresponde al estado líquido, no importa de que forma hemos alcanzado dicho punto.
Aparentemente hay algún tipo de paradoja o razonamiento engañoso en el desarrollo previo, de modo que cabe preguntarse: Donde está la falla del razonamiento presentado?. Por un camino vemos formarse líquido y por el otro no, y los productos finales son idénticos.
Y aunque parezca extraño no hay trucos en el desarrollo previo. La falla se encuentra en la definición de Líquido y Gas que empleamos regularmente.
Por el camino de la Fig.2 afirmamos que el punto "Z" corresponde a un líquido porque lo vimos formarse a expensas de la fase que estaba presente (en algún momento comenzaron a formarse gotas más densas que su entorno, a partir del fluido sometido a presión).
Sin embargo veremos que sólo es válido hablar de Líquido o de Gas cuando ambos coexisten. En esos casos no hay dudas: el líquido es la fase más densa. Pero cuando hay una sola fase presente, se debe hablar de fluido monofásico para evitar errores conceptuales que pueden conducir a malas interpretaciones en el comportamiento de los sistemas termodinámicos. De este modo podemos afirmar que los puntos "A" y "Z" corresponden a fluidos monofásicos de muy diferente densidad.
Y esto nos permite trabajar sin ambigüedades con las zonas de la curva cercanas al punto crítico. En esta zona las densidades del gas y del líquido son lo suficientemente cercanas como para que resulte difícil diferenciar ambas fases excepto que coexistan en el mismo recipiente. En cualquier otro caso se debe hablar de fluido monofásico y la eventual formación de gas o de líquido (a partir de la otra fase) dependerá del camino termodinámico siguiente.
Y todo esto nos lleva a un concepto que es fundamental en la caracterización del comportamiento de los reservorios de gas y petróleo: Un gas a alta presión tiene propiedades muy cercanas a las de un líquido. Entre otros fenómenos no habituales, esta característica conduce a la posibilidad de que un gas disuelva líquidos.